がん治療では免疫を活性化し、免疫細胞を介してがん細胞を叩く方が、抗がん剤や放射線治療で直接がん細胞を殺傷するよりも効果的です。さらに、その効果も長続きします。
- 個別の病気
- 治療法・栄養
がん免疫抑制解除による免疫治療

がん治療においては免疫を活性化し免疫細胞を介してがん細胞を叩くのが、抗がん剤や放射線治療で直接がん細胞を殺傷するよりも効果的で、さらにその効果も長続きします。
しかし、がん患者にはTreg(制御性T細胞)、疲弊キラーT細胞、MDSC(骨髄由来免疫抑制細胞)という3つの免疫抑制細胞が免疫抑制に関与していますので、これらの免疫抑制を解除しなければ免疫活性ができません。
がん治療では、これらの免疫抑制細胞をコントロールすることが重要になってきます。
私たちは、ヤーボイでCTLA-4/B7系 (Treg)、オプジーボでPD-1/PDL-1系、オプジーボと水素ガスで疲弊キラーT細胞、低容量化学療法とアバスチンとタヒボの併用でMDSCの免疫抑制を解除することで、かつてないような臨床効果を認めています。
キラーT細胞の発見と向けられた期待
免疫の主体は、がん細胞を認識してがん細胞のみを殺傷するキラーT細胞です。このキラーT細胞を誘導することが免疫の最終目標になります。キラーT細胞は1991年、ベルギーのThierry Boonのグループにより発見されました (1)。
それまではがん細胞だけに発現するがん抗原が存在すること、さらにこれを認識するリンパ球が存在することなど夢にも考えられておりませんでしたので、まさにこれは画期的な発見だったわけです。
このキラーT細胞の発見により、「これでがんを撲滅できる」と世界中の免疫治療家が考え、癌ワクチン療法、樹状細胞療法などをこぞって行いました。しかし、その結果は大きく期待はずれのものでした。
期待したような結果が得られなかったのは、何故なのか(第一の矛盾)。これに先立つこと1950年代、がん免疫監視機構(2)(Cancer Immunosurveillance)の概念が提唱されました。
しかし、このがん免疫監視機構説では「がん免疫監視機構が存在するのに、何故、がん細胞は増殖し、がんが発生することがあるのか」という第二の矛盾を説明できませんでした。
上記二つの矛盾点を経時的に説明し、発展させた概念がSchreiberらによって提唱されました。それが「がん免疫編集説(cancer immunoediting)」です (3)。
免疫系とがんの関わり
「がん免疫編集説」の概念によれば、発がんにおける免疫系とがんとの関わりは「排除相」「平衡相」「逃避相」と呼ばれる3相に分けられます。
最初に生体にあらわれた変異細胞(がん細胞)は免疫原性※1が高いため、免疫系は異物だと判断し、免疫担当細胞が攻撃することによって排除されます(排除相)。
しかし、免疫原性の低いがん細胞は免疫担当細胞からの攻撃にさらされないため、排除されることなく長期にわたって選択的に生存します(平衡相)。最終的には免疫抑制機構を獲得することにより、免疫監視から逃避して増殖することで進行し、臨床的がんになります(逃避相)。
すなわち、がん免疫はがん細胞を殺傷しようとするキラーT細胞とこれを抑制する免疫抑制機構とのバランスによってコントロールされているのです。
※1:抗原などの異物が体内で免疫応答を起こす性質のこと。
「免疫抑制機構」の発見
免疫抑制機構の発見は2000年代になされました。2018年、この偉業に対し、ノーベル医学生理学賞が授与されます。本庶 佑先生(京都大学)によってPD-1/PDL-1系の免疫抑制機構、そしてJames Patrick Allison先生(米国)によってCTLA-4/B7系の免疫抑制機構が発見されました。
キラーT細胞上のPD-1分子とがん細胞上のPDL-1が結合すると、キラーT細胞はがん細胞を殺傷することができなくなります。また、樹状細胞上のB7分子はT細胞上のCD28と結合してT細胞を活性化しますが、Treg細胞上のCTLA-4と結合するとT細胞を活性化することができなくなります。
PD-1/PDL-1の免疫抑制を外す抗体がオプジーボ、CTLA-4/B7の免疫抑制を外す抗体がヤーボイで、これらの抗体によって免疫抑制を解除できます。
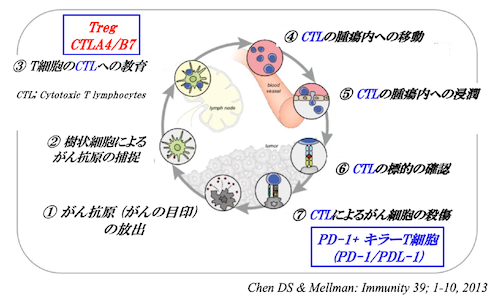
<図1>がん免疫サイクル
このキラーT細胞と免疫抑制との関連は、がん免疫サイクルを把握すると理解しやすくなります(図1)。がん免疫サイクルは、以下7つの過程からなっています。
がん免疫サイクルにおける7つの過程
①がん細胞の破壊
②樹状細胞によるがん抗原の補足
③T細胞の教育と活性化
④CTLの腫瘍への移動
⑤CTLの腫瘍内への侵入
⑥CTLの標的の確認
⑦CTLによるがん細胞の殺傷
③T細胞の教育と活性化 のステップで、Tregによる免疫抑制がかかっています。また、⑦CTLによるがん細胞の殺傷 のステップでは、PD-1/PDL-1による免疫抑制がかかっています。
③のステップのTregによる免疫抑制を解除するためにはヤーボイを使用し、⑦のステップではPD-1/PDL-1による免疫抑制を解除するためにオプジーボを使用します。
免疫抑制解除によって示される臨床効果
しかし、PD-1を発現したキラーT細胞がさらにがん抗原刺激を受けると、別の免疫チェックポイント分子であるTim-3を発現した「疲弊キラーT細胞」 (PD-1+Tim-3+ CD8+ T cells)が出現してきます。
この疲弊キラーT細胞にはオプジーボが効きませんし、疲弊キラーT細胞が増加してくると予後が不良になります。水素ガスは、この疲弊キラーT細胞のミトコンドリア機能不全を改善し、オプジーボが効くように変えていきます。
さらに、がんが進行してくると骨髄由来免疫抑制細胞 (MDSC)という免疫抑制細胞が出現してきます。MDSCはがんにおける免疫抑制の中心的存在と考えられています。また、MDSCは上記のTregと疲弊キラーT細胞を誘導し、がんが発育するのに有利な免疫抑制環境を形成することが知られています(図2)。
がん患者にはTreg、疲弊キラーT細胞、MDSCという3つの免疫抑制細胞が免疫抑制に関与しています。がん治療において、これらの免疫抑制細胞をコントロールすることが重要になってきます。
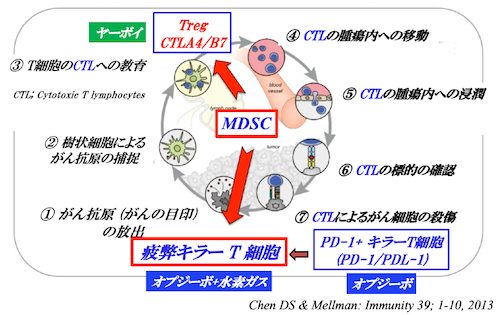
<図2>免疫抑制とがん免疫サイクル
MDSCに関しては、ゲムシタビン(4)、シスプラチン(5)、ドセタキセル(6)といった抗がん剤、また分子標的薬であるアバスチン(7)が(MDSCを)抑制することが報告されています。
また、最近になって、私たちはサプリメントの「タヒボ」がMDSCを抑制する可能性を見出し、現在その治験を施行しているところです。
ヤーボイでCTLA-4/B7系、オプジーボでPD-1/PDL-1系、オプジーボと水素ガスで疲弊キラーT細胞、低容量化学療法とアバスチンとタヒボの併用でMDSCの免疫抑制を解除することで、かつてないような臨床効果を認めています (図3)。この治療を“AKAGI Methods”と名付けています。
MST(Median Survival Time)は、そのグループの患者さんの50%が亡くなるまでの期間を指しますが、HLCでは156日、HLC+オプジーボでは351日に延びました。さらに、AKAGI MethodsではNR (まだ、患者さんの50%以上が生存していることを意味する)となっており、素晴らしい臨床効果が認められています。
私たちはこのAKAGI Methodsを多くのがん患者様、特にがん難民の方々に知って頂き、その福音をもたらしていきたいと考えています。
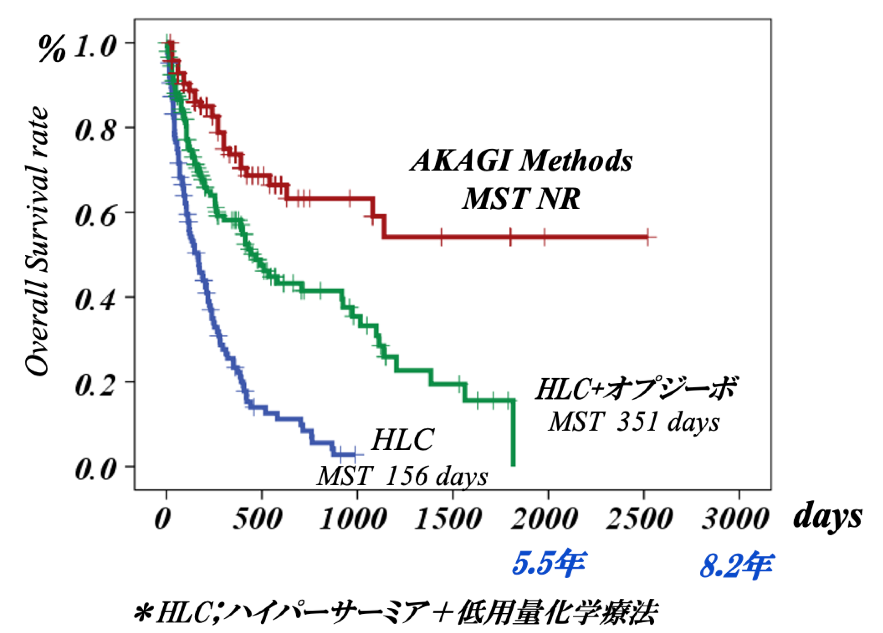
<図3>治療別の生存曲線 (2013/11〜2022/10)
<参考文献>
1.Thierry Boon et al. Immunology Today 1997; 18(6): 267-268.
2.Burnet FM. Prog Exp Tumor Res. 1970;13:1-27.
3.Schreiber RD, et al. Science. 2011;331:1565-1570.
4.Hank KLe et al. International Immunopharmacology 2009; 9:900-909.
5.Glenn F.Van Wigchergen et al. Oncoimmunology 2021; 10:
6.Krithika N Kodumudi et al. Clin Cancer Res. 2010; 16(18):4583-94.
7.Po-Hao Feng et al. Journal of Thoracic Oncology 2018; 13 (7):958-967.
同じタグの記事を読む



